免疫療法のはじまり
日本の免疫療法のはじまりは、1944年に登場した「丸山ワクチン」であるというのが大方の見方でしょう。もともとは皮膚結核のワクチンとして日本医科大学の丸山千里博士が開発したものですが、丸山ワクチンの治療対象だった結核やハンセン病の患者さんには、どういうわけかがんが少ないということに丸山博士が気づき、がん治療にも使われるようになりました。同じ流れで、結核菌由来の「BCG療法」が登場してきました。
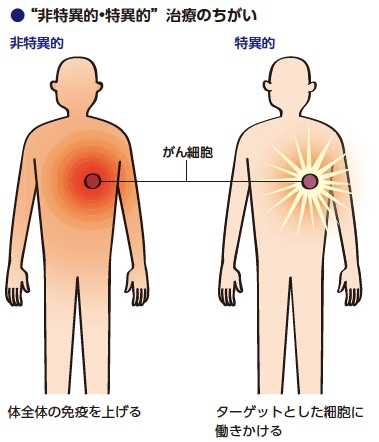
これらの特徴は、個々の免疫細胞というより、免疫力全体にアプローチするということです。ですから、がんにも結核にもその他の病気にも同様に効果が期待できるというわけです。
こうした免疫力全体に働きかける治療法を、「非特異的治療」と呼んでいます。免疫を上げるとうたっているサプリメントも、同じ分類に入るでしょう。これらは焦点が絞り切れてない分、がんという難敵と戦うには非力だといえます。
丸山ワクチンから少し遅れて、1948年に登場したのが「ハスミワクチン」でした。
開発者の蓮見喜一郎博士は、この時代では画期的な発想である〝患者さんのがん細胞だけを狙い撃つ〟という視点をもったワクチン作りに挑みました。攻撃のターゲットを絞り切れない非特異的な療法ではなく、〝特異的〟にがんを攻撃するという免疫療法です。
蓮見博士はハスミワクチンを用い、多くのがん患者さんを治癒させました。現在までにハスミワクチンの受診者は、国内外合せて12万人を超えています。
1980年代から分子生物学の発達により、がんに対する免疫力の働きがより詳細に解明されてきました。そこで注目されたのが、サイトカインという物質でした。
免疫システムはさまざまな種類の免疫細胞が情報交換し、活性化したり抑制したりしながら成り立っています。それらの情報を運搬する媒体物質がサイトカインです。
サイトカインのなかでも、免疫細胞を活性化させる物質が特定されるようになり、これを人工的に合成して体内へ入れてあげればいいという考え方が登場しました。インターフェロンが夢の治療薬と騒がれたことがありますが、これも免疫細胞を活性化させるサイトカインのひとつです。 しかし、副作用があったり、効果も期待ほどではなかったりで、残念ながら現在ではがん治療の分野では、ほとんど使われていません。
LAK療法から分化したさまざまな細胞療法
次に登場したのが、LAK(リンフォカイン活性化キラー細胞)療法です。患者さんのリンパ球を採取し、それを体外で活性化させてから体内に戻す――という方法です。 1970年代、アメリカ国立衛生研究所のローゼンバーグ博士が開発し、発表したときにはがん治療の光明として大きな期待が集まり、日本でもこの療法に取り組む施設が登場しました。
しかし、現実には期待しただけの効果が出ずに、尻すぼみ状態になってしまいました。
LAK療法の欠点はTリンパ球の増殖という、非常に大まかに分類された枠組みでの活性化しかできなかったことでした。リンパ球にはさまざまな免疫細胞が含まれていて、どれを活性化すればよいのかというところまで焦点が絞り切れていなかったです。 その後、LAK療法ではがんを攻撃する免疫細胞であるT細胞のうち“αβ(アルファ・ベータ)T細胞〟を中心に増殖させていることがわかり、現在はこの「αβT細胞療法」が主流となっています。がんを治癒させるというより、患者さんのQOL(生活の質)を高める方法として使われている場合が多いようでする。
また、それとは別に〝γδ(ガンマ・デルタ)T細胞〟を活性化する「γδT細胞療法」も登場しています。ただ、一般のT細胞には大きな欠点があります。それは、敵であるがん細胞の情報を伝えないと攻撃をしない点です。敵の情報が伝えられていないT細胞は、すぐそばにがん細胞があっても素知らぬ顔で通り抜けてしまうのです。
LAK療法とは別に、NK細胞だけを活性化させて体内に戻す「NK細胞療法」があります。NK細胞というのは、細胞をチェックして同じ組織型でない細胞の場合は、すべて異常な細胞とみなして攻撃を仕掛けて排除してしまう免疫細胞です。T細胞のようにがんに関する細かな情報は必要としませんから、とても使いやすい細胞です。 NK細胞は攻撃型Tリンパ球に比べて攻撃力も落ちるため数が必要ですが、体外で増殖させることよって、それらの欠点をカバーすることが可能です。
ただし、免疫細胞は異物の目印(抗原)に向かって攻撃を仕掛けますが、がん細胞のなかには正常細胞と同じ組織型の細胞を表面に出しているものも少なくないため、NK細胞だけでがん細胞をすべて駆逐することは不可能だという現実も覚えておいてください。 最近発見されたNKT細胞(T細胞とNK細胞の両方の性格をもつ細胞)を使った「NKT細胞療法」は、NK細胞療法の進化したものと考えていいでしょう。

治療を変えた樹状細胞
LAK療法でわかったことは、リンパ球を活性化させることばかりにエネルギーを注ぎ込んでも、限界があるということでした。
つまり、T細胞をがん攻撃の精鋭である“キラーT細胞(CTL)”に変身させるためには、活性化にこだわるのではなく、敵であるがんの目印をきちんと教え込むことこそが肝心だったわけです。「TIL療法」は、そうした欠点を補おうと開発された方法で、切除したがん細胞や採取した胸水、腹水からリンパ球を分離して培養し、数を増やして体内に戻します。がん細胞や胸水、腹水に含まれているリンパ球は、がん細胞の情報を認識している可能性が高いので、これを使おうという発想です。
しかし、問題として残ったのは、手術によってがん細胞が摂取できなければ行えない点と、分離して培養したリンパ球は、体内に入れて7日から10日ほどの寿命しかありませんから、治療を何度も繰り返して行う必要があるという点でした。これでは、なかなか一般的な方法として定着しません。
ところが、免疫機構の司令塔ともいうべき“樹状細胞”が治療に使えるようになり、様相はがらりと変わったのでした。
最初に行われたのは、「CTL療法」です。樹状細胞を使って試験管の内部でCTL(キラーT細胞)を誘導し、それを体内へ戻すという方法です。CTLというのは“敵を認識したT細胞”のことで、非常に高い攻撃力をもっています。しかし、TIL療法と同じように、CTLの寿命も7〜10日なので、治療を何度も繰り返さなければならないという欠点は改善されないままでした。
CTL療法は、CTLの工場を体外にもつようなものです。これでは供給体制に限界が出てきます。
それなら、体内でCTLを作り出すことができないだろうかと考える研究者が出てきました。それができれば理想の免疫療法となることは間違いありません。
その方法が、現在免疫療法の最前線で行われている「がんワクチン」だと理解してもらってよいでしょう。
人工抗原の限界
がんワクチンとは、『樹状細胞に覚えさせたがん抗原(がんの目印)をT細胞に伝えることで、患者さん自身のがんをターゲットにして(特異的に)免疫力が攻撃を仕掛ける仕組みを誘導するもの』を指します。がんワクチンは、“樹状細胞(DC)療法”と呼ばれる場合もあります。 樹状細胞療法は大きく2種類に分けられます。
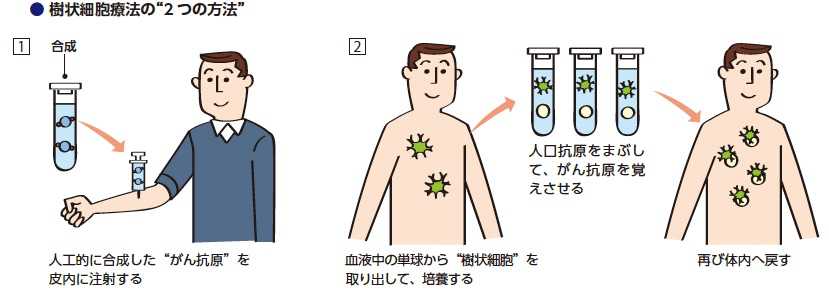
1つ目が、「がんペプチド療法」です。1990年以降、がん抗原となるペプチド(アミノ酸がつながっている状態のもの)が、次々とわかってきました。ペプチド療法は、がん抗原を人工的に合成して皮下、あるいは皮内に注射するという方法です。 注射されたペプチドは、皮下や皮内にある樹状細胞に認識され、その樹状細胞からT細胞に情報が伝達されて、CTLが誘導されます。そして、誘導されたCTLががん細胞を攻撃することでがんを縮小、あるいは消滅させてしまおうというものです。
しかし、体内の樹状細胞はとても少ないので、たくさんのCTLを誘導することができません。手術後の再発予防という使い方ならいいでしょうが、進行したがんに対しては、力不足はいなめません。
もう1つは、体外で樹状細胞に抗原を覚えさせる方法です。血液中の単球から育てた樹状細胞を培養して数を増やし、そこに人工抗原や切除して粉砕したがん細胞をまぶすことで樹状細胞に抗原を記憶させます。その樹状細胞を体内に戻せば、大量の樹状細胞がT細胞に抗原を教えますから、先のペプチド療法とは比べ物にならないくらいのCTLが作られます。がんを攻撃する力は、当然はるかに強力なものになります。
しかし、この方法には抗原の問題が付きまといます。人工抗原の選び方、組み合わせ方が、果たして患者さんのがんの抗原と合致したものになっているのかどうかという疑問が出てくるからです。それなら、患者さん自身のがん細胞を使えばいいではないかとなりますが、手術のときにがん細胞を保存し、培養液の中で増殖を続けるような“初代培養”という方法が試みられています。
相乗効果を誘導するHITV療法
人工抗原の限界を踏まえ、がぜん注目されるのが「HITV療法」です。
ここまで見てきておわかりの通り、がんは単独の療法で消してしまえるほど甘くはありません。いくら免疫療法が優れているといっても、それだけで完結させようという発想には無理があるのです。 最先端の免疫療法を施した上で、さらに従来の治療法の利点を組み合わせていくやり方が、もっとも効果的で理にかなった治療法といえるでしょう。
しかし、闇雲にあれもこれもと組み合わせても期待した効果は出ないものです。がん治療は1+1は2になるとは限りません。組み合わせや順番によって、0やマイナスになることもあるし、100とか1000の効果を発揮する場合もあります。HITV療法は、まさにその相乗効果を誘導する療法なのです。
HITV療法の特徴は、患者さんの樹状細胞をがん細胞に直接遭遇させることです。そうすることで、樹状細胞は確実にがん抗原を認識し、十分な量のCTLを誘導します。さらに、放射線や抗がん剤を組み合わせることで、ワクチンの効果を最大限に引き出すデザインもなされています。
HITV療法は、自動車にたとえるならハイブリッドといえるでしょう。放射線や抗がん剤がガソリンエンジン、ワクチンは電気モーターです。それらを組み合わせることで、体へのダメージを最小限に抑え、同時に強力な性能を発揮させることができるのです。
将来はHITV療法に遺伝子治療の技術が加わり、より身体に優しく、強力な療法へと進化することが期待されています。そのとき、人類はがんという難敵から真に解放されるのかもしれません。
◆がん免疫療法の変遷と特徴
- 丸山ワクチン
| 長所 | 安価で手軽に受けられる |
| 限界 | 攻撃のターゲットがあいまいで、進行がんには非力 |
- ハスミワクチン
| 長所 | 尿などから作れるので手間がかからず、再発予防には高い効果を発揮する |
| 限界 | 進行がんや肥大したがんには効果が薄い |
- LAK療法
| 長所 | 患者さんのQOLを高めるには効果的 |
| 限界 | T細胞にがん抗原を伝えられない場合が多い |
- NK(NKT)療法
| 長所 | NK細胞はT細胞のように敵(がん)を教えなくても自動的に攻撃する |
| 限界 | 効果を出すには数が必要。 NK細胞が認識しないがん細胞も多い |
- TIL療法
| 長所 | がん細胞などから直接リンパ球を分離、培養するので、 攻撃対象を認識したCTLが得られる |
| 限界 | がん細胞などが必要。CTLの寿命が7~10日程度しかない |
- CTL療法
| 長所 | 確実にCTLが誘導できる |
| 限界 | CTLの寿命が短いため、何度も治療を行わねばならない。 樹状細胞も用いるので、高価な治療となる |
- がんペプチドワクチン
| 長所 | 樹状細胞を取り出す必要がない。 人工抗原を用いるので費用も安く、再発予防には有効 |
| 限界 | 免疫機構はペプチドに由来する抗原しか認識しないので、 抗原の種類がたくさん必要になる |
- 樹状細胞療法(がん細胞を使う)
| 長所 | 体外で樹状細胞を増やし、そこにがん細胞を粉砕して混ぜるので、 確実に患者さんのがん抗原を認識させられる |
| 限界 | 患者さんのがん細胞が不可欠。 手術後に冷凍保存しておく必要がある |
- 樹状細胞療法(人工抗原を使う)
| 長所 | 実際のがん細胞を必要としない |
| 限界 | 抗原が合致するかどうかが定かではない |
- HITV療法
| 長所 | がん細胞に直接樹状細胞を送り届けるため、確実に抗原を 認識させてCTLを誘導することができる。 放射線や抗がん剤とコラボレーションさせることにより、 ワクチンの効果を向上させることが可能 |
| 限界 | がんが体中に散らばっている場合、あるいは著しく 肥大した腫瘍に対しては改良の余地を残すい |







